Заботясь о том, чтобы полученный результат был максимально быстрым и точным, собрали для Вас пять статей от производителя " Beckman Coulter", в которых расскажем об:
- относительном центробежном ускорении;- разделении частиц;
- типах роторов для центрифуг;
- воспроизведении протоколов центрифугирования;
- K-факторе
Воспроизведение протоколов центрифугирования
В ходе исследований часто возникает необходимость воспроизвести условия центрифугирования, о которых вы прочитали в опубликованном протоколе. Просматривая такие протоколы, проверяйте, что инструкция содержит всю необходимую информацию, включая название ротора или величину максимального радиуса, RPM или RCF и время центрифугирования. Например, до тех пор, пока вам не известна модель ротора или его максимальный радиус, нет ни единой возможности узнать, какое RCF требуется, чтобы выполнить необходимое разделение.
Ротор JS-5.2 с rmax = 226 мм разгоняется до 4 050 х g. Разница в 50 х g кажется несущественной, но если ее проигнорировать, она может быть достаточной для того, чтобы повлиять на результаты разделения. Подготовка компонентов крови и этап осаждения, которые описаны в инструкциях к наборам для радиоиммуноанализа (RIA), – один из примеров, когда для качественного разделения требуется уделить условиям центрифугирования особо пристальное внимание.
Дно многих адаптеров, предназначенных для загрузки небольших пробирок, имеет толщину 10-15 мм или больше. В большинстве случаев такое уменьшение эффективного rmax не влияет на результат разделения. Но если вы хотите рассчитать точное значение RCF при использовании адаптеров, то сначала нужно определить истинное значение rmax, вычтя из rmax ротора толщину дна адаптера.
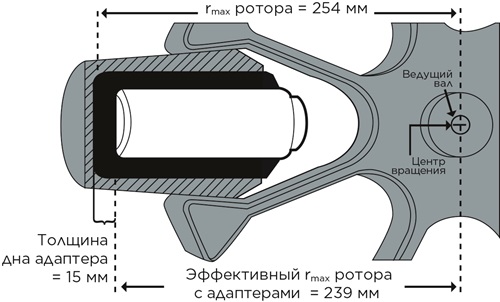
Определение радиуса бакетного ротора с адаптером
Выше сказанное не означает, что центрифугирование, выполненное в одном роторе, нельзя воспроизвести в роторе с другим rmax. Можно скомпенсировать разницу в rmax и достичь таких же результатов, изменив скорость вращения ротора или время центрифугирования. Используйте следующую номограмму, чтобы оценить RCF и скорость вращения для роторов различных радиусов.
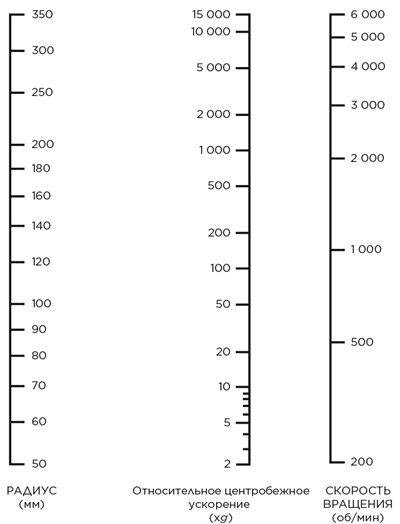
Номограмма выбора скорости вращения центрифуги
Также подходящую скорость вращения можно рассчитать, выразив RPM из уравнения:
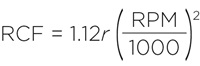
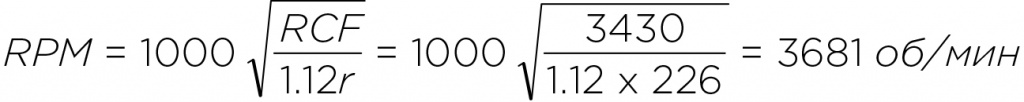
Таким образом, ротор JS-5.2 будет развивать 3 430 x g при скорости вращения 3 681 об/мин. Если в исходных данных указаны радиус и скорость вращения использованного ротора, то вам сначала нужно будет определить RCF c помощью номограммы или уравнения:
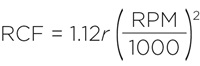
В некоторых случаях бывает лучше изменить продолжительность центрифугирования, а не величину центробежной силы. Например, вы хотите повторить результаты, которые получаются при центрифугировании при 3 000 х g в течение 10 мин. Можно ли в этом случае использовать ротор JR-3.2, максимальное RCF которого составляет 2&nbsnbsp;300 x g? Да, но в этом случае вам придется центрифугировать образцы немного дольше. Необходимое время можно найти с помощью следующего уравнения:
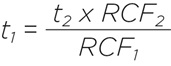
где t1 – время центрифугирования для ротора JR-3.2,
t2 – время, указанное в протоколе,
RCF1 – RCF ротора JR-3.2 при максимальной скорости вращения,
RCF2 – RCF, указанное протоколе.
Подставляя данные из нашего примера, получаем:
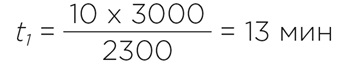
Время, рассчитываемое по указанным рекомендациям, соответствует времени, которое следует задать на таймере центрифуги. Оно будет потрачено на разгон ротора и центрифугирование с рабочей скоростью, но не на торможение. Время торможения зависит от веса ротора с нагрузкой, типа тормозной системы и пользовательских настроек торможения. Если выбраны настройки для максимально быстрого торможения, то на замедление ротора и его полное торможение потребуется 1-3 мин.
Конечно же осаждение частиц продолжается и во время торможения центрифуги, но его скорость постепенно уменьшается. Используя настройки для максимально быстрого торможения, можно добиться минимальных затрат времени. Однако быстрое торможение на последнем этапе остановки ротора может оказаться слишком резким в случае использования больших бутылей или мешков с кровью и привести к нежелательному перемешиванию и ресуспенидрованию осажденного материала. Наличие ресуспендированного материала легко ошибочно принять за плохое разделение.
Предупреждение: перед изменением условий центрифугирования убедитесь, что ваш образец не пострадает от более жестких условий или длительного центрифугирования. Небольшие изменения, как правило, не вызывают проблем. Но некоторые биологические образцы могут испортиться, если центрифугирование выполняется слишком долго, да еще и без охлаждения. Некоторые коммерческие наборы реагентов для определенных видов анализов могут быть чувствительными ко времени центрифугирования. В случае сомнений, следуйте советам оригинальных инструкций настолько близко, насколько это возможно.
Посмотрите и другие статьи по принципам центрифугирования от Beckman Coulter:
Относительное центробежное ускорение
Разделение частиц
Типы роторов
K-фактор
Оригинал этой статьи можно посмотреть ТУТ